ホーム > 薬事承認支援 > 医療機器 QMS適合性調査
医療機器 QMS適合性調査
医療機器の製造販売業者並びに製造業者は、承認または一変の取得時、輸出用医療機器等の製造開始時、または承認取得後5年を経過するごと及び、輸出用医療機器等の製造開始後5年を経過するごとに、医療機器に係る製造所においてQMS適合性調査を受ける必要があります。
QM適合性調査とは(薬機法第23条の2の2)
医療機器等を製造している製造所が、厚生労働省令で定める基準(医療機器及び体外診断用医薬品の製造管理及び品質管理の基準に関する省令:QMS省令)に適合し、適正な管理の下にこれら医療機器等を製造しているかどうかを調査するもので、製造所に赴き実地に調査するほか書面による調査を行います。また、これらの調査は次のように分けられます。
QMS適合性調査の種類
- 承認前適合性調査
承認、一部変更承認、輸出時 - 承認後適合性調査
既存承認に係る定期調査、輸出用定期調査
※適合性調査申請対象医療機器:クラスⅡ、クラスⅢ、クラスⅣに該当する医療機器
QMS調査と調査権者
独立行政法人 医薬品医療機器総合機構(PMDA)
- 新医療機器、国家検定医療機器、細胞組織医療機器、特定生物由来医療機器、クラスⅣ医療機器を製造する国内製造所
- 医療機器及び体外診断用医薬品の海外製造所(第三者登録認証機関で実施する製造所を除く)
都道府県
PMDA及び第三者登録認証機関で実施する製造所以外の国内製造所
第三者登録認証機関
指定された医療機器及び体外診断用医薬品を製造する国内及び海外の製造所
医療機器QMSと調査権者
| 医療機器の種類 | 国内製造所 | 海外製造所 |
|---|---|---|
| 新医療機器 | PMDA | PMDA |
| 細胞組織医療機器 | PMDA | PMDA |
| クラスⅣ | PMDA | PMDA |
| クラスⅢ | 都道府県 | PMDA |
| クラスⅡ | 都道府県 *認証基準あるものは、第三者登録認証機関 |
PMDA *認証基準あるものは、第三者登録認証機関 |
| クラスⅠ | - | - |
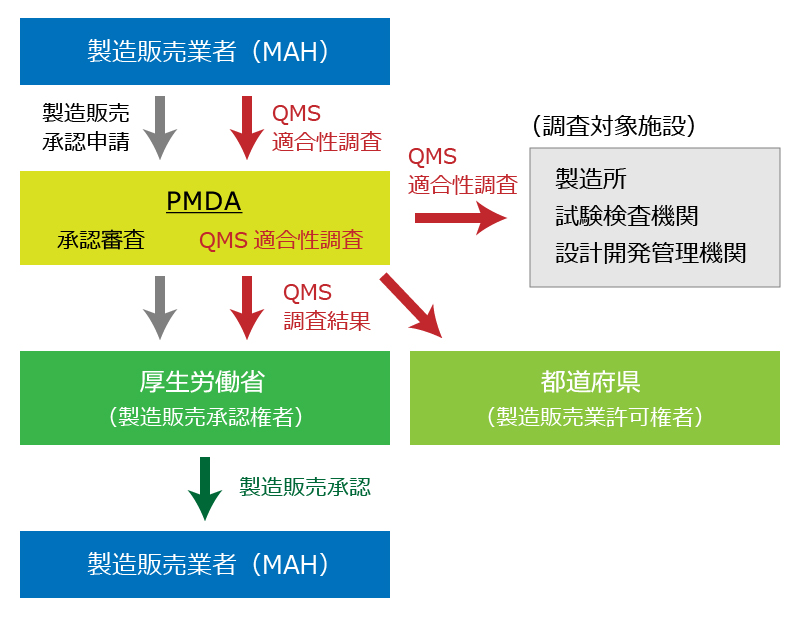
QMS適合性調査の流れ(PMDAによる承認前適合性調査の場合)
Japan MDCは、皆様が抱えられている様々な問題に対して、親身なるサービスおよびサポートを行っている医療機器のトータル・コンサルティング会社です。 是非お気軽にお問い合わせください。




 資料ダウンロード
資料ダウンロード